Isótopos são átomos de um elemento químico cujos núcleos têm o mesmo número atómico, ou seja, os isótopos de um certo elemento contêm o mesmo número de protões designado por "Z", mas diferentes números de massa (a massa atómica é vulgarmente designados por "A").
| 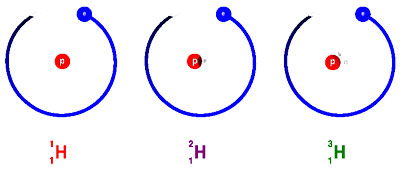
Exemplo dos isótopos de hidrogénio
| |||
A palavra isótopo, que significa "no mesmo lugar", advem do facto de que os isótopos se situam no mesmo lugar na tabela periódica, isto é, pertencem ao mesmo grupo e ao mesmo período. A diferença nos pesos atómicos resulta de diferenças no número de neutrões nos núcleos atómicos, ou seja, os isótopos são átomos que possuem a mesma quantidade de protões, mas não a mesma de neutrões.
Ex.: O átomo de Hidrogénio possui três formas de isótopos (ver figura acima): o Prótio (1 protão apenas) o Deutério (1 protão e 1 neutrão) e o Trítio (1 protão e 2 neutrões). No entanto, 99,9% do Hidrogénio existe na forma de Prótio.
| ||||
Na nomenclatura científica, os isótopos são designados pelo nome do elemento seguido por um hífen e pelo número de nucleões - partículas que se encontram no núcleo (protões e eletrões) no núcleo atómico (ex: ferro-57, urânio-238, hélio-3). Na forma simbólica, onúmero de nucleões, também designado por número de massa, é escrito como um prefixo subido do símbolo químico (ex: 57Fe, 238U, ³He).
Existem 339 isótopos naturais na Terra. Mais de 3100 são conhecidos.
aluno: joao paulo da silva
| ||||
Sua avaliação sobre blog .
domingo, 4 de maio de 2014
Sobre isópotos
Assinar:
Postar comentários (Atom)

Nenhum comentário:
Postar um comentário