Teoria do Octeto
Átomo estável conta com oito elétrons na última camada
A Teoria do Octeto determina que os átomos
dos elementos ligam-se uns aos outros na tentativa de completar a sua
camada de valência com oito elétrons. Sendo assim, o átomo é considerado
estável quando apresentar 8 elétrons em sua última camada da
eletrosfera.
Na tentativa de atingir a estabilidade sugerida pela Regra do Octeto, cada elemento precisa ganhar ou perder (compartilhar) elétrons nas ligações químicas, como no exemplo a seguir:
Na tentativa de atingir a estabilidade sugerida pela Regra do Octeto, cada elemento precisa ganhar ou perder (compartilhar) elétrons nas ligações químicas, como no exemplo a seguir:

Ligação de Sódio (Na) e Cloro (Cl): o átomo de sódio doa um elétron para o átomo de Cloro.
Em uma visão mais dinâmica, este compartilhamento de elétrons ficaria assim:

Vamos observar o seguinte:
• O átomo de Sódio doa um elétron para o átomo de Cloro;
• Forma-se o íon Na+ com oito elétrons na camada de valência (última camada da eletrosfera);
• O íon de cloro aparece com uma carga negativa (Cl-), indicando que recebeu um elétron e atingiu a estabilidade.
Segundo a Teoria do Octeto, as moléculas ou íons tendem a ser mais estáveis quando a camada de elétrons externa de cada um dos seus átomos está preenchida com a configuração de um gás nobre (oito elétrons). Essa teoria explica porque os elementos sempre formam ligações: para atingirem a estabilidade.
Exceções à regra do Octeto
Berílio (Be)
É uma exceção à Regra do Octeto porque é capaz de formar compostos com duas ligações simples, sendo assim, estabiliza-se com apenas quatro elétrons na camada de valência.

Como o hidrogênio (H) precisa ceder dois elétrons para realizar a ligação (H ― Be ― H), o átomo de Berílio (Be) compartilha seus elétrons e atinge a estabilidade.
Alumínio (Al)
É uma exceção à Regra do Octeto porque atinge a estabilidade com seis elétrons na camada de valência. O átomo de Alumínio tende a doar seus elétrons e assim pode formar três ligações simples com outros átomos:
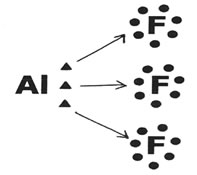
Neste caso, o Alumínio (Al) formou três ligações com três átomos de Flúor (F).
Boro (B)
Forma substâncias moleculares com três ligações simples.
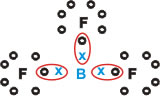
Repare que o Boro (B) tem a tendência de doar seus elétrons para os átomos de Flúor (F), este sim obedece à Regra do Octeto, necessitando de oito elétrons na camada de valência. Como o Boro cede seus elétrons, o flúor se estabiliza com o Octeto formado.
Por Líria Alves
Graduada em Química
Equipe Brasil Escola
fonte:
http://www.brasilescola.com/quimica/teoria-octeto.htm
http://www.brasilescola.com/quimica/excecoes-regra-octeto.htm
Aluno: Robson Júnior
1º Ano "C"

Nenhum comentário:
Postar um comentário