Geometria Molecular:
A geometria molecular é a forma em que as molecular ficam após
serem arranjadas pelos átomos ligados.
Cada molécula apresenta sua forma característica da natureza das ligações, ligação iônica ou covalente, e também do que os constituem , como elétrons de valência e eletronegatividade.
Pode-se dizer que é o estudo de como os átomos estão distribuídos espacialmente em uma molécula.
Iai? Parece simples? Não se assuste, no começo pode parecer muito complexo, mas com o tempo você pega o jeito da coisa.
Iai? Parece simples? Não se assuste, no começo pode parecer muito complexo, mas com o tempo você pega o jeito da coisa.
Pares Eletrônicos (importante)
Aconselho a você que ainda não viu nossa postagem sobre a teoria de repulsão, a não ler este artigo. Procure no Blog mais sobre essa teoria.
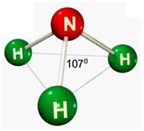
Bom, dando um pequeno resumo, a teoria da repulsão dos pares eletrônicos de valência (TRPEV). Os pares eletrônicos (Valência) do átomo central, repelem-se, tendem a manter uma distância entre sí, a distância é verificada no angulo formado entre eles.
Bom, dando um pequeno resumo, a teoria da repulsão dos pares eletrônicos de valência (TRPEV). Os pares eletrônicos (Valência) do átomo central, repelem-se, tendem a manter uma distância entre sí, a distância é verificada no angulo formado entre eles.
Formas Geométricas
Podemos tornar com facilidade o modelo geométrico, seguindo os seguintes passos, retirados do site:
InfoEscola.
InfoEscola.
- Contagem do número total de elétrons de valência (levando em consideração a carga, se for um íon);
- Determinação do átomo central (geralmente, o menos eletronegativo e com o maior número de ligações);
- Contagem do número de elétrons de valência dos átomos ligantes;
- Cálculo do número de elétrons não ligantes (diferença entre número total e o número de elétrons dos átomos ligantes com a camada de valência totalmente completa);
- Aplicação do modelo da TRPEV.
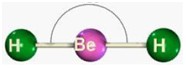
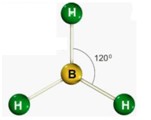
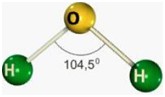
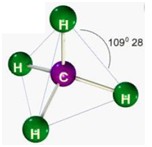
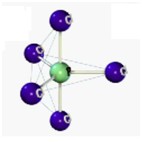
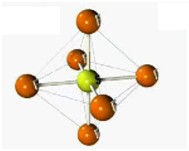
Desse modo, as geometrias mais comuns obtidas (observando-se, principalmente, os pares eletrônicos não ligantes) são:
| Geometria | Pares eletrônicos totais | Pares eletrônicos não ligantes | Pares eletrônicos ligantes |
| Linear | 2 5 6 | 0 3 4 | 2 2 2 |
| Triangular | 3 | 0 | 3 |
| Angular | 3 4 | 1 2 | 2 2 |
| 4 | 0 | 4 | |
| Piramidal | 4 | 1 | 3 |
| Bipiramidal | 5 | 0 | 5 |
| Octaétrica | 6 | 0 | 6 |
Após ver o gráfico, veja os modelos moleculares.
Bom gente, é isso. Espero que gostem, mas ainda não acabou! Assistam esse vídeo, que me ajudou muito, e acho que os ajudará também:
Fonte: InfoEscola, Wikipédia.
Aluno: Maxwel Queiroz do Nascimento
Aluno: Maxwel Queiroz do Nascimento

Nenhum comentário:
Postar um comentário