Quando estudamos química é normal (
(Eba! explodir MUN RA RA !!)
Mas nem vá pensando que é só misturar, mexer KABUUUMM!!!!!
(AFF.. Morguei)
1° -Escute o ''profi'' :D
O professor sempre vai passar as especificações necessárias fique atento
2°- Tire dúvidas ;)
Não vá fazendo o que der na telha analise bem antes de fazer o que foi pedido.
3°- Use batas brancas com manga comprida...
(Ha Ha :3 )
A manga comprida protege os braços e a cor branca pois ajuda a detectar resíduos ou manchas.
5° Garotas prendam os cabelos !!!
Você não que correr o rico do seu capelo pegar fogo em quando você aquece uma substancia O.o
6° Use luvas e óculos ADEQUADOS !!
Vai que a substancia seja corrosiva, você não quer perder a mão (ou quer ?) e tem mais em pense em usar aquele óculos escuro super divo que você tem em casa, lembrando, você vai para o laboratório de química e não pra praia ok ?
(Falo msm... nem adianta reclamar. )
7°-Não levar alimentos para o laboratório.
Isso é meio obvio, já pensou se em vez do copo de refri for o béquer ?? O.o
8°- Não beber as substancias !!!
Galera eu sei que a cor é bonitinha mas não adianta você não vai ter super poderes se fizer isso ...
9°-Use a aparelhagem limpa
Quanto mais limpos os materiais melhor será o resultado da experiência.
10° - Lave as mãos a cada experiência
Para sua própria proteção a higiene tem que prevalecer :D
Espero que vcs tenham gostado do post de hoje !!!
e sigam as instruções ok ? ok.
Aqui foi Rayanne !
Câmbio, Desligo .


.jpg)



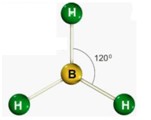
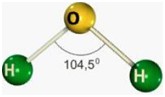
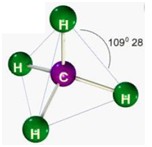
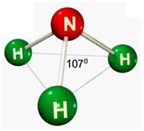

















.jpg)