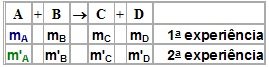
Portanto, temos:

Exemplo:
Quando 2 gramas de hidrogênio reagem com 16 gramas de oxigênio verifica-se a formação de 18 gramas de água; do mesmo modo, quando 12 gramas de carbono reagem com 32 gramas de oxigênio ocorre a formação de 44 gramas de gás carbônico.
Quando 2 gramas de hidrogênio reagem com 16 gramas de oxigênio verifica-se a formação de 18 gramas de água; do mesmo modo, quando 12 gramas de carbono reagem com 32 gramas de oxigênio ocorre a formação de 44 gramas de gás carbônico.
Lei de Proust (Lei das proporções constantes, definidas ou fixas)
Quando, em várias experiências, duas substâncias se reúnem para formar um composto, sempre o fazem numa mesma proporção. Esnasa proporção é característica de cada reação, isto é, independe da quantidade de reagentes utilizados.
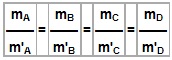
Exemplo:
Para a reação entre, por exemplo, hidrogênio e oxigênio formando água, os seguintes valores experimentais podem ser obtidos:
Para a reação entre, por exemplo, hidrogênio e oxigênio formando água, os seguintes valores experimentais podem ser obtidos:
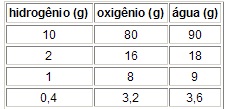
No exemplo da água:
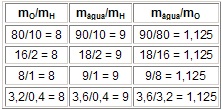
Obs.: Conseqüências da Lei de Proust:
a) composição centesimal e,
b) cálculos estequiométricos.
b) cálculos estequiométricos.
Aluna:Alyne Falcão

Nenhum comentário:
Postar um comentário