Sua avaliação sobre blog .
quinta-feira, 27 de março de 2014
quarta-feira, 26 de março de 2014
terça-feira, 25 de março de 2014


| Devemos lembrar que para ajustar uma equação química usamos unicamente os coeficientes. Em nenhum caso trocamos os subíndices das fórmulas. Se fizermos isso vamos alterar a identidade da substância. Vamos ver um exemplo? |

 |
Os coeficientes usados no balanceamento de uma equação química devem ser sempre os menores números inteiros possíveis, pois não dá para imaginar 1/2 molécula de oxigênio! |


domingo, 23 de março de 2014
Videos de demostração de DESTILAÇÃO
Destilação Fracionada
Destilação Simples
Como Fazer um desse em casa
Aluno: Aline Araújo Cordeiro
Fonte: Youtube
Destilação Simples e Fracionada
A destilação simples e a fracionada são métodos especiais de separação de misturas homogêneas, ambas consistem no aquecimento da mistura até a ebulição e em seguida condensar os vapores do líquido.

Destilação Simples: Separa um sólido e um líquido de uma mistura homogênea. Ela consiste em separar o líquido em forma de vapor e esse vapor depois é condensado através de um aparelho chamado condensador.
Equipamentos utilizados na destilação simples:
- bico de Bunsen: aparelho que realiza o aquecimento;
- balão de destilação: onde a mistura é aquecida;
- condensador: os vapores produzidos por esse aquecimento passam pelo condensador onde são resfriados e transformados em líquido novamente através do processo de liquefação. A parte sólida da mistura não se evapora, pois não é volátil, sendo assim permanece no balão de destilação;
- frasco coletor: é onde se recolhe o líquido.
Destilação Fracionada: Esse processo consiste no aquecimento de uma mistura de mais de dois líquidos que possuem pontos de ebulição diferentes. Assim, a solução é aquecida e separa-se inicialmente o líquido com menor ponto de ebulição e, em seguida, o líquido com o ponto de ebulição maior.
Exemplos:
- Os derivados do petróleo são separados por destilação fracionada, onde cada componente é destilado em uma temperatura diferente: baixas temperaturas separam a gasolina e o querosene, já na temperatura em torno de 300 ° C, são destilados os óleos e as parafinas.
- Nos alambiques se retira o álcool através da destilação do mosto (garapa) da cana. Esse mosto é o suco da cana que passa por um processo de decomposição por microorganismos chamados de fermentação.
Fonte:http://www.mundoeducacao.com/quimica/destilacao-simples-fracionada.htm
Lei de Lavoisier(Lei da conservação da massa)
Numa reação química em um sistema fechado, a soma das massas dos reagentes é igual à soma das massas dos produtos. A partir disso, lembra-se da célebre frase dita por Lavoisier: “Nada se cria, nada se perde, tudo se transforma”.
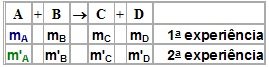

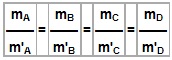
Observe que, para cada reação, a massa do produto é igual à soma da massa dos reagentes, o que concorda com a Lei de Lavoisier. As massas dos reagentes e dos produtos que participam de uma reação podem ser diferentes, mas as relações entre elas são sempre constantes.

Portanto, temos:

Exemplo:
Quando 2 gramas de hidrogênio reagem com 16 gramas de oxigênio verifica-se a formação de 18 gramas de água; do mesmo modo, quando 12 gramas de carbono reagem com 32 gramas de oxigênio ocorre a formação de 44 gramas de gás carbônico.
Quando 2 gramas de hidrogênio reagem com 16 gramas de oxigênio verifica-se a formação de 18 gramas de água; do mesmo modo, quando 12 gramas de carbono reagem com 32 gramas de oxigênio ocorre a formação de 44 gramas de gás carbônico.
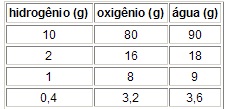
Lei de Proust (Lei das proporções constantes, definidas ou fixas)
Quando, em várias experiências, duas substâncias se reúnem para formar um composto, sempre o fazem numa mesma proporção. Esnasa proporção é característica de cada reação, isto é, independe da quantidade de reagentes utilizados.
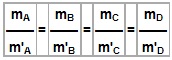
Exemplo:
Para a reação entre, por exemplo, hidrogênio e oxigênio formando água, os seguintes valores experimentais podem ser obtidos:
Para a reação entre, por exemplo, hidrogênio e oxigênio formando água, os seguintes valores experimentais podem ser obtidos:

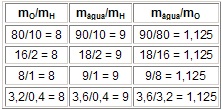
No exemplo da água:

Obs.: Conseqüências da Lei de Proust:
a) composição centesimal e,
b) cálculos estequiométricos.
b) cálculos estequiométricos.
Aluna:Alyne Falcão
sábado, 22 de março de 2014
1. Reação de Síntese ou Adição:É aquela em que duas substâncias reagem originando um único produto.
A + B → C
Exemplo: Reação de formação do dióxido de carbono (gás carbônico), a partir de dois reagentes, o carbono e o gás oxigênio.
C + O2 → CO2
2. Reação de decomposição: É o inverso da de Síntese, uma única substância origina duas ou mais.
A → B + C
Exemplo: Nos airbags acionados, ocorre a rápida decomposição de um composto de sódio (NaN3(s)), produzindo gás nitrogênio e sódio.
2 NaN3 (s) → 2 N2 (g) + 2 Na(s)
3. Reações de dupla troca: duas substâncias compostas reagem originando outras duas.
AB +XY → AY + XB
Exemplo: Reação entre sulfato de cobre e hidróxido de sódio resultando em precipitado azul de hidróxido de cobre.
CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2
4. Reações de simples troca: Uma substância composta reage com uma simples e geram outras duas substâncias compostas e simples.
A +XY → AY + X
Exemplo: Reação de ácido clorídrico com zinco liberando gás hidrogênio (efervescência).
Zn + 2HCl → ZnCl2 + H2
5. Reações de Oxirredução: São as que envolvem perda (oxidação) ou ganho (redução) de elétrons.
Exemplo: Na fotossíntese, reação realizada pelas plantas clorofiladas, as moléculas de clorofila utilizam energia solar para produzir gás oxigênio.
6 H2O + 6 CO2 → 6 O2 + C6H12O6
Nesta reação o oxigênio sofreu uma oxidação, pois seu Nox (número de oxidação – carga elétrica das espécies químicas) aumentou, ou seja, ele perdeu elétrons. Já o hidrogênio reduziu, ou seja, ele ganhou elétrons.

Planta aquática liberando oxigênio resultante da fotossíntese, uma reação de óxido-redução.
6. Reações com Óxidos: Óxidos são compostos binários, isto é, formados por dois elementos, sendo que o oxigênio é o mais eletronegativo entre eles.
6.1- Óxido básico + Ácido → Sal + H2O: O óxido básico apresenta caráter iônico, em que o metal terá geralmente carga +1 e +2. Ao reagir com a água, origina bases. E ao reagir com ácidos, origina sal e água.
Exemplos:
Na2O + H2O → 2NaOH
Na2O + 2HNO3 →2NaNO3 + H2O
Na2O + 2HNO3 →2NaNO3 + H2O
6.2- Óxido ácido + Base → sal + H2O: O óxido ácido apresenta caráter covalente, e geralmente é formado por ametais. Ao reagir com a água, origina ácidos. E ao reagir com bases, origina sal e água.
Exemplos:
SO2 + H2O →H2SO3
SO2 + 2KOH →K2SO3 + H2O
SO2 + 2KOH →K2SO3 + H2O
6.3-Óxido básico + Óxido ácido → Sal: Neste caso, o cátion do óxido básico reage com o óxido ácido formando um sal.
Aluno:Hilton Alves
Fonte:http://www.brasilescola.com/quimica/tipos-reacoes-quimicas-2.htm
Os níveis de trabalho da Química
O “mundo” ao qual estamos acostumados — das coisas que podemos ver, sentir, perceber, tocar ou medir — é o ponto de partida para as pesquisas em Química. Dizemos que as coisas que pertencem a esse “mundo” são do nível macroscópico.
Assim, por exemplo, quando falamos que a água é um líquido incolor e inodoro, estamos nos referindo ao aspecto macroscópico da água. Quando dizemos que a água apresenta PF = O °C, PE = 100 °C (ao nível do mar) e d 1,0 g/cm3, a 20 °C, estamos relatando propriedades macroscópicas da substância água.
Ao propor explicação para as leis (essas explicações são as teorias), os químicos utilizam frequentemente os conceitos de átomo e de molécula, entidades que pertencem ao nível microscópico.
Para facilitar a comunicação, os químicos lançam mão das representações, que incluem os símbolos (que representam os átomos dos elementos), as fórmulas (que representam as substâncias) e as equações químicas (que representam as reações químicas).
Uma visão microscópica sobre a decomposição da água
sexta-feira, 21 de março de 2014
Equações Quimicas
EQUAÇÃO QUÍMICA
A forma que representamos a reação química chama-se Equação Química.
Equação Química – é a representação gráfica da reação química.
Nela colocamos os elementos que estão envolvidos na reação, de forma abreviada, e como ela aconteceu, através de símbolos já padronizados.
As Equações Químicas representam a escrita usada pelos químicos e de forma universal, ou seja, é a mesma em qualquer país.
As substâncias que participam da reação química são chamadas de produtos ou reagentes na equação química.
Reagentes (1° membro) – são as substâncias que estão no início da reação. São as que irão reagir, sofrer a transformação.
Produtos (2° membro) – são as substâncias resultantes da reação química.
Exemplo: Duas moléculas de gás hidrogênio juntam-se com uma molécula de gás oxigênio formando duas moléculas de água.
2H2 + O2 → 2 H2O
reagente produto
reagente produto
Observe que o H2 e o O2 são reagentes e H2O é o produto.
Para representar a reação química, utiliza-se uma seta apontando para o lado direito, indicando a transformação.
Em cima da seta, são utilizados alguns símbolos indicando as condições nas quais a reação deve ocorrer.
∆ - calor
aq – aquoso ( em água)
cat – catalisador
λ – energia luminosa
aq – aquoso ( em água)
cat – catalisador
λ – energia luminosa
Em cada substância pode haver os seguintes símbolos:
↑ - desprendimento de gás
↓ - precipitação de um sólido
↑ - desprendimento de gás
↓ - precipitação de um sólido
Nas equações químicas, as substâncias podem aparecer com seus estados físicos:
(s) – sólido
(l) – líquido
(g) – gasoso
(s) – sólido
(l) – líquido
(g) – gasoso
Exemplo:
C (s) + O2 (g) → CO2 (g)
C (s) + O2 (g) → CO2 (g)
Att: Igor Da Silva
Distinção entre elemento e Substância simples.
Não confunda Elemento com Substância
|
|---|
Robert Boyle no século XVII, fez uma afirmação importantíssima quando afirmou que substâncias simples é o mesmo que elemento. Tal afirmação, foi extremamente relevante para o desenvolvimento da Química.
Contudo, com os avanços da Química no século XX, passou-se a definir elemento de outra maneira e, como conseqüência, passou a haver distinção entre as terminologias elemento e substâncias simples. Elemento químico (ou, simplesmente, elemento) é o conjunto de átomos que apresentam um mesmo número atômico, isto é, mesmo número de prótons no núcleo. São conhecidos pouco mais de cem elementos, que estão agrupados na tabela periódica. Cada elemento químico, que possui um nome e um número atômico próprios, é representado por um símbolo. Substância química (ou, simplesmente, substância), por sua vez, é uma porção de matéria caracterizada por propriedades bem definidas (como pontos de fusão e de ebulição, densidade, composição química, etc.). Uma substância, que invariavelmente é formada por átomos de um ou mais elementos químicos, é representada por uma fórmula química.
Elemento químico é representado por um símbolo.
As substâncias em cujas fórmulas só aparecem átomos de um elemento químico são chamadas de substâncias simples. Quando há átomos de mais de um elemento químico, trata-se de substância composta ou composto químico.Substância química é representada por uma fórmula. Para fixar essas idéias, considere os exemplos a seguir. ► Átomos do elemento químico hidrogênio (símbolo H) se unem covalente, formando as moléculas da substância simples gás hidrogênio (fórmula H2). ► Átomos do elemento químico oxigênio (símbolo O) se unem por ligação covalente, formando as moléculas da substância simples gás oxigênio (fórmula O2). ►Átomos do elemento químico oxigênio (símbolo O) se unem por ligação covalente, formando as moléculas da substância simples gás ozônio (fórmula O3). ► Átomos dos elementos químicos hidrogênio e oxigênio (símbolos H e O) se unem por ligação covalente, formando as moléculas da substância composta água (fórmula H2O). ► Átomos do elemento químico ferro (símbolo Fe) se unem por ligação metálica, formando o retículo cristalino metálico da substância simples ferro (fórmula Fe). ► Átomos do elemento químico prata (símbolo Ag) se unem por ligação metálica, formando o retículo cristalino metálico da substância simples prata (fórmula NaCI). |
|---|
http://www.agracadaquimica.com.br/index.php?&ds=1&acao=quimica/ms2&i=23&id=335
Att: Igor Da silva
REAÇÕES QUÍMICAS
| Reação Química é um fenômeno onde os átomos permanecem intactos. Durante as reações, as moléculas iniciais são "desmontadas" e os seus átomos são reaproveitados para "montar" novas moléculas. |
No nosso cotidiano, há muitas reações químicas envolvidas, como por exemplo, no preparo de alimentos, a própria digestão destes alimentos no nosso organismo, a combustão nos automóveis, o aparecimento da ferrugem, a fabricação de remédios, etc.



EQUAÇÃO QUÍMICA
A forma que representamos a reação química chama-se Equação Química. Equação Química – é a representação gráfica da reação química.
Nela colocamos os elementos que estão envolvidos na reação, de forma abreviada, e como ela aconteceu, através de símbolos já padronizados.
As Equações Químicas representam a escrita usada pelos químicos e de forma universal, ou seja, é a mesma em qualquer país.
As substâncias que participam da reação química são chamadas de produtos ou reagentes na equação química.
Reagentes (1° membro) – são as substâncias que estão no início da reação. São as que irão reagir, sofrer a transformação.
Produtos (2° membro) – são as substâncias resultantes da reação química.
Exemplo: Duas moléculas de gás hidrogênio juntam-se com uma molécula de gás oxigênio formando duas moléculas de água.
2H2 + O2 → 2 H2O
reagente produto
Observe que o H2 e o O2 são reagentes e H2O é o produto.reagente produto
Para representar a reação química, utiliza-se uma seta apontando para o lado direito, indicando a transformação.
Em cima da seta, são utilizados alguns símbolos indicando as condições nas quais a reação deve ocorrer.
∆ - calor
aq – aquoso ( em água)
cat – catalisador
λ – energia luminosa
Em cada substância pode haver os seguintes símbolos:
↑ - desprendimento de gás
↓ - precipitação de um sólido
Nas equações químicas, as substâncias podem aparecer com seus estados físicos:
(s) – sólido
(l) – líquido
(g) – gasoso
Exemplo:
C (s) + O2 (g) → CO2 (g)
Aluno: Ítalo Mateus de Espindola Fernandes
quinta-feira, 20 de março de 2014
Transformações químicas
Conceito
Constantemente
a matéria que nos cerca sofre transformações. Em algumas transformações somente
o estado ou a agregação do material são alterados, caracterizando uma
transformação física da matéria. Em outros casos essas transformações resultam
na produção de um novo material, com características diferentes do inicial.
As transformações químicas ocorrem quando
há alteração na constituição do material, formando assim novas substâncias.
Ao
aproximarmos um fósforo aceso de um recipiente com álcool, este começa a
queimar. Essa queima é uma transformação química, pois há alteração na
constituição do álcool, que ao entrar em contato com o ar oxigênio, se converte
em gás carbônico e água, liberando energia.
Chamamos de
sistema o conjunto de materiais isolados para estudo. Uma maneira de comprovar
a existência de uma transformação química é através da comparação do estado
inicial e final do sistema. Algumas evidências podem ser observadas, permitindo
verificar a ocorrência dessas transformações, como modificação na cor, cheiro, estado
físico e temperatura.Fonte:www.manualdomundo.com.br
Modelo atômico de Dalton
Modelo atômico de Dalton
Estrutura
Em 1803 Dalton publicou o trabalho Absorption of Gases by Water and Other Liquids, (Absorção de gases pela água e outros líquidos), neste delineou os princípios de seu modelo atômico.Segundo Dalton:
- átomos de elementos diferentes possuem propriedades diferentes entre si;
- átomos de um mesmo elemento possuem propriedades iguais e de peso invariável;
- átomo é a menor porção da matéria, e são esferas maciças e indivisíveis;
- nas reações químicas, os átomos permanecem inalterados;
- na formação dos compostos, os átomos entram em proporções numéricas fixas 1:1, 1:2, 1:3, 2:3, 2:5 etc.;
- o peso total de um composto é igual à soma dos pesos dos átomos dos elementos que o constituem.
Aluno: Erison Cavalcante Alves
Moleculas
Molécula
Rigorosamente, uma molécula corresponde a uma união entre dois ou mais átomos que, em termos de diagramas energéticos (energia potencial U em função da separação espacial de seus átomos), é representada por uma depressão suficiente para confinar pelo menos um estado vibracional (um estado ligante). 1 .
Ligação molecular
Um antigo conceito diz que uma molécula é a menor parte de uma substância que mantém suas características de composição e propriedades químicas, entretanto tem-se conhecimento atualmente que as propriedades químicas de uma substância não são determinadas por uma molécula isolada, mas por um conjunto mínimo destas.Muitas substâncias familiares são feitas de moléculas (por exemplo açúcar, água, e a maioria dos gases) enquanto muitas outras substâncias igualmente familiares não são moleculares em sua estrutura (por exemplo sais, metais, e os gases nobres).
Quando iniciou-se o estudo e formulação da teoria atômica, era dado o nome de átomo a qualquer entidade química que poderia ser considerada fundamental e indivisível. As observações no comportamento dos gases levaram ao conceito de átomo como unidade básica da matéria e relacionada ao elemento químico, desta forma, houve uma distinção da molécula como "porção fundamental de todo composto", obtida pela união de vários átomos por ligações de natureza diferente.
Basicamente, o átomo abriga em seu núcleo partículas elementares de carga elétrica positiva (prótons) e neutra (nêutrons), este núcleo atômico é rodeado por uma nuvem de elétrons em movimento contínuo (eletrosfera). A maioria dos elementos não são inertes, por isso, quando dois átomos se aproximam, há uma interação de natureza eletromagnética entre as nuvens eletrônicas e os núcleos dos respectivos átomos. As nuvens eletrônicas se rearranjam em torno dos núcleos de forma a minimizar a energia potencial do sistema formado pela união dos mesmos, e uma ligação química estabelece-se. Os átomos se ligam e formam agregados que podem ou não constituir moléculas dependendo da natureza da ligação química estabelecida. Quando há compartilhamento entre os núcleos de alguns de seus elétrons e estes elétrons permanecem em regiões espaciais bem definidas no espaço (nos orbitais) de forma a envolverem apenas os dois átomos em questão, tem-se uma ligação molecular. Quando há o confisco de elétrons de um átomo pelo outro, formam-se íons e tem-se uma ligação iônica. Na ligação metálica, elétrons são compartilhados, mas, ao contrário da ligação molecular, isto não se dá de forma localizada entre dois átomos vizinhos. Uma única nuvem de elétrons, com elétrons doados por todos os átomos, distribui-se sobre todos os átomos simultaneamente e de forma bem deslocalizada (o que confere as características de maleabilidade e ductibilidade aos metais).
A natureza de suas moléculas determina as propriedades químicas das substâncias moleculares. Estas dependem da natureza dos átomos que integram suas moléculas, da natureza e da intensidade da ligação estabelecida, orientação espacial destes, e também da interrelação entre moléculas, que pode dar-se mediante vários mecanismos distintos, a saber por polarização induzida, por ligações por ponte de hidrogênio, e outros.
Uma ligação entre dois átomos de hidrogênio e um de oxigênio (H2O), forma uma molécula de água; uma ligação entre dois átomos de cada um desses mesmos elementos produz peróxido de hidrogênio (H2O2), vulgarmente chamado de água oxigenada, cujas propriedades são bem diferentes das da água.
Os átomos também se ligam em proporções idênticas, mas podem formar isômeros, que são moléculas diferentes. No álcool etílico (CH3CH2OH) e o éter metílico (CH3OCH3), é a diferença de arrumação dos átomos que estabelece ligações diferentes, moléculas diferentes, e portanto substâncias moleculares com propriedades diferentes.
A distribuição espacial dos átomos que formam uma molécula depende das propriedades químicas e do tamanho destes. Quando igualmente eletronegativos os átomos formam ligações classificadas como apolares. Moléculas com átomos cujas eletronegatividades sejam diferentes também podem formar moléculas apolares em função de uma distribuição simétrica destes átomos, mas em caso de ausência de simetria, as moléculas formadas serão polares.
Substâncias moleculares podem também, de forma similar às iônicas e aos metais, formar cristais.
Aluno: Erison Cavalcante Alves
quarta-feira, 19 de março de 2014
Átomos
Átomo: é a menor porção em que pode ser dividido um elemento químico, mantendo ainda as suas propriedades. Os átomos são os componentes básicos das moléculas e da matéria comum. São compostos por partículas sub-atômicas. As mais conhecidas são os prótons, os nêutrons e os elétrons. Assim podemos concluir que os átomos são partículas elementares constituintes da matéria e, que, tudo é composto por átomos
Elétrons: Uma partícula elementar negativamente carregada. Elétrons executam um movimento desordenado ao redor do núcleo atômico em orbitais.
Prótons: partícula subatômica que tem uma carga elétrica unitária positiva.
NÚCLEO: porção central do átomo, carregada positivamente e constituída por prótons e nêutrons.
Aluno: Álef Alves Santos
terça-feira, 18 de março de 2014
Os instrumentos de um
laboratório
Anteriormente
vimos que muitos processos de separação de misturas envolvem vários equipamentos
de laboratório. Há equipamentos de vidro, de ferro (e outros metais), de
porcelana, de plástico. Alguns serão listados nesse artigo.
→ Usado em
destilações, onde nele se coloca o líquido destilado.
→ Usado para
armazenar, aquecer líquidos e fazer reações com desprendimento de
gases.
→ Por ter
volume definido, é utilizado no preparo de soluções.
→ É de uso
geral. Serve para fazer reações, pesar sólidos, dissolver
substâncias.
→ utilizado em
análises volumétricas, principalmente na titulação.
VI
– Condensadores
RETO: apresenta uma
superfície de condensação pequena não sendo indicado para o resfriamento de
líquidos de baixo ponto de ebulição.
DE BOLAS: usado
em refluxo. Permitem que vapores condensados retornem ao balão
de
origem.
DE SERPENTINA:
apresenta uma maior superfície de condensação é usado principalmente no
resfriamento de líquidos de baixo ponto de ebulição.
VII –
Pipetas
VOLUMÉTRICA:
permitem medir um volume fixo de líquido com elevada precisão
GRADUADA:
permitem medir volumes variáveis de líquidos.
→ Utilizado em
titulações, aquecimento de líquidos e para dissolver soluções.
→ Utilizado em
conjunto com o funil de Buchner em filtrações a vácuo e nas reações obtenção de
gases.
→ Utilizado em
conjunto com o kitasato em filtrações a vácuo, na função de filtro
→ É utilizada
para medir e transferir volume dos líquidos.
→ Utilizado em
extração, decantação, separação de líquidos imiscíveis
→ Utilizado na
filtração e para retenção de partículas sólidas
XIV – Vareta de
vidro
→ Utilizada
para agitar, homogeneizar substâncias e auxiliar na transferência de um líquido
de um recipiente para outro.
→ Utilizado
para reações em pequenas escalas, como testes de reação. Pode ser aquecida pelo
bico de Bunsen.
XVI – Vidro
relógio
→ Utilizado
para pesagens, para cobrir béqueres, em evaporações de líquidos de forma
lenta.
→ Utilizado
para triturar e pulverizar amostras sólidas.
XIX
– Espátula
→ Utilizada
para transferir substâncias sólidas.
→ Utilizado
para aquecer matérias infamáveis
→ Utilizado
para efetuar aquecimentos de soluções em vidrarias diversas de
laboratório
→ Utilizada
para lavagens de materiais ou recipientes através de jatos de água, álcool ou
outros solventes
→ Utilizado em
operações como: Filtração, Suporte para Condensador, Bureta, Sistemas de
Destilação etc. Serve também para sustentar peças em geral.
XXIV
– Cadinho
→ Utilizado na
secagem, no aquecimento e na calcinação de substâncias.
XV – Anel ou
argola
→ Utilizado
como suporte para a tela de amianto, funil de separação, funil simples, entre
outros.
ALUNO:Italo Mateus de Espindola Fernandes
Assinar:
Comentários (Atom)































