Ligações de Hidrogênio!!
Introdução
Hoje Galera eu vou falar um pouco sobre ligações do
hidrogênio: o que pra, que serve, como ocorre e exemplos.
As ligações de hidrogénio, também designadas por pontes de
hidrogénio, consistem num tipo de interação eletrostática entre moléculas e
ocorrem entre moléculas que têm hidrogénio ligado a átomos muito
eletronegativos, sobretudo azoto, oxigénio ou flúor.A ligação estabelece-se,
devido ao facto de as moléculas serem fortemente polares, quando o átomo de
hidrogénio parcialmente positivo de uma molécula é atraído pelo par de eletrões
não partilhado (não ligante) do átomo eletronegativo de outra molécula.As ligações
de hidrogénio são tanto mais fortes quanto maior for a polaridade da ligação
covalente entre o hidrogénio e o outro elemento.As ligações de hidrogénio entre
as moléculas de amoníaco são mais fracas que as existentes entre as de água,
uma vez que a polaridade da molécula de amoníaco é menor que a da molécula de
água.O átomo de hidrogênio é o único átomo participante de compostos que só
possui uma única camada de elétrons (a camada K) que é ao mesmo tempo a
primeira e última e possui um único elétron. A camada K se completa com 2
elétrons, de modo que, para atingir a estabilidade química, o H precisa ganhar
ou compartilhar 1 elétron de outro átomo. Ao se ligar a um elemento muito
eletronegativo, tal como o N, o O e o F, seu único elétron fica tão afastado na
direção do átomo eletronegativo que o próton que compõe seu núcleo fica
praticamente nu, uma vez que o H, diferentemente dos outros átomos, não possui
outras camadas de elétrons entre a camada de valência e o núcleo atômico. Deste
modo, o efeito polarizante do núcleo do hidrogênio acaba sendo o mais
pronunciado de todos. Para reduzir a tensão gerada, o átomo de H envolvido em
ligações com N, O ou F interage fortemente com a eletrosfera de átomos
vizinhos, de modo a "cobrir" parcialmente o próton quase exposto do
núcleo do átomo de H. Esse efeito é ainda mais pronunciado se o átomo com o qual
o H interage for um átomo pequeno e muito eletronegativo. Num átomo pequeno,
estes elétrons estão mais localizados, se encontram confinados em uma camada
menos volumosa e por isso interagem mais facilmente. Se o átomo for muito
grande, os elétrons de valência estão mais "espalhados" pela volumosa
camada de valência desse átomo, dificultando a interação. É por isso que o
átomo de cloro, embora seja tão eletronegativo quanto o nitrogênio, não forma
ligações de hidrogênio. Consequentemente, haverá uma interação eletrostática
entre o átomo de H com forte carga parcial positiva com os elétrons
não-ligantes do outro átomo participante, A ligação de hidrogênio pode ser
considerada um caso particularmente intenso de interação dipolo-dipolo
permanente. Devido ao pequeno tamanho, o átomo de H se aproxima bastante do
outro átomo, o que, combinado com a forte interação entre o próton do H e os
elétrons do outro átomo, faz com que esta seja a interação mais forte entre as
moléculas.
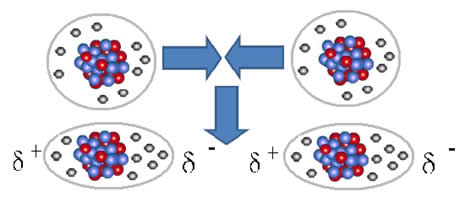
Como exemplo temos a água(H2O), na qual o hidrogênio de uma
das moléculas formadoras da substância interage com o núcleo eletro denso do
oxigênio, necessariamente de outra molécula de água vizinha, o que ocasiona o
fenômeno de tensão superficial. No geral, todas as características e
propriedades físicas particulares da água resultam de sua estrutura molecular.
A diferença de eletronegatividade entre os átomos de hidrogênio e de oxigênio
gera uma separação de cargas. Assim, os átomos positivos de hidrogênio de uma
molécula interagem com os átomos negativos de oxigênio de outra molécula
vizinha. Essas Ligações de Hidrogênio criam uma cadeia que pode se rearranjar
muitas vezes, permitindo que a água líquida flua em toda parte. Os átomos de
hidrogênio e oxigênio podem interagir com muitos tipos de moléculas diferentes,
razão pela qual a água é considerada o solvente mais poderoso conhecido.
Conclusão
Bom Galerinha foi isso, para quem quer saber algo a mais
olhe nas páginas abaixo , vejam os vídeos e leia a apostila. Então Bons estudos
!!!!!
Aluno:Yuri Marcena.