Subníveis de Energia
Com o advento de novas descobertas na área da mecânica quântica entre os séculos XIX e XX, o modelo de Rutheford-Bohr, consolidado em 1913, o qual se aplicava muito bem aos átomos
Nos experimentos com espectroscopia com a difração da luz emitida pela transição eletrônica dos átomos, foi possível observar que havia uma raia de diferentes comprimentos de onda emitidos, dentro de uma mesma estreita faixa, de um mesmo nível de energia. Foi então que, em 1919, o físico inglês Arnold Sommerfeld (1868-1951) buscou uma solução, ele propôs que os elétrons deveriam assumir órbitas elíptcas variadas dentro de um mesmo nível, com mesma energia, permitindo um "espectro de raias" na emissão de luz. Cada órbita recebeu o nome de subnível e, cada qual, foi identificado com uma letra: s, p, d ou f (letras relacionadas as palavras do inglês: sharp, principal, diffuse e fundamental; visto a descriçao do comportamento de cada orbital).
Em 1924, o físico inglês Edmund Clifton Stoner(1889-1973) chegou ao número máximo de elétrons comportado por cada subnível:
s: 2 elétrons, p: 6 elétrons, d: 10 elétrons e f:14 elétrons.
Para conhecer a relação de energia de cada subnível, basta verificar o diagrama criado por Linus Pauling a cerca dadistribuição eletrônica de um átomo no estado fundamental:
Energia:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5 s< 4d < 5p < 6s < 4f < 5d < 6p < 7s < 5f < 6d < 7p
Seguindo a sequência de distribuição energética, pode-se representar os elétrons de um átomo da seguinte forma:
Exemplo:
nitrogênio N: 1s²2s²3s³
Sendo que, por convenção, para 3s³, por exemplo, tem-se 3 elétrons no subnível p do 4º nível.
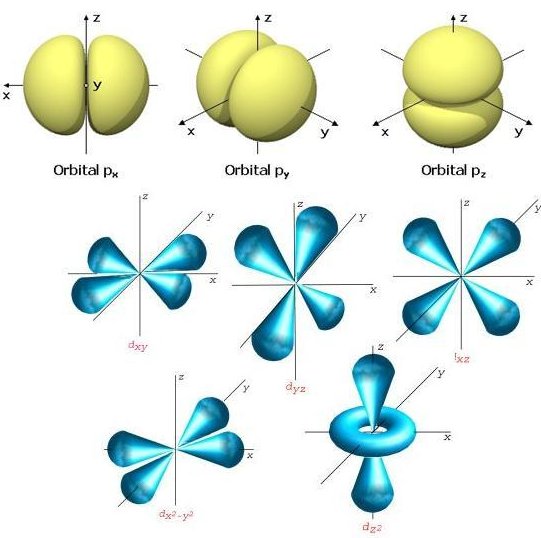
Os subníveis também possuem representaçao espacial de acordo com a distribuição de probabilidade dos elétrons, dada por:


Nenhum comentário:
Postar um comentário